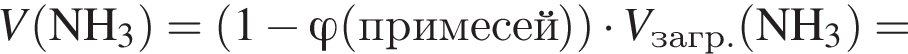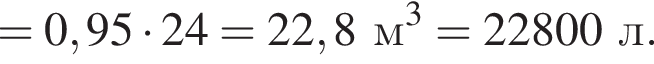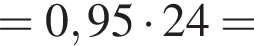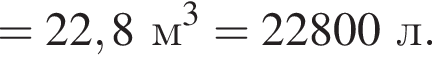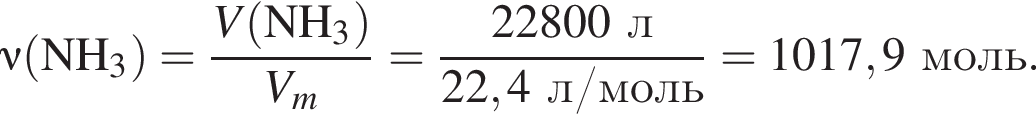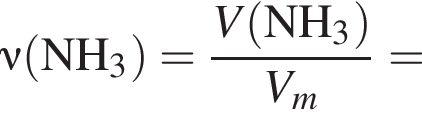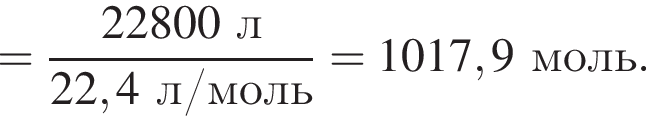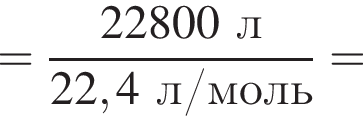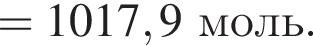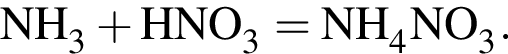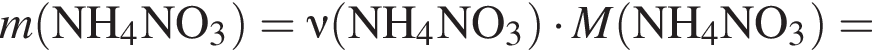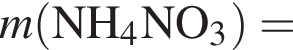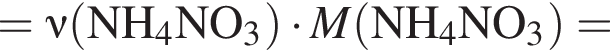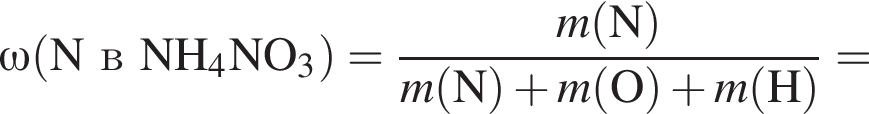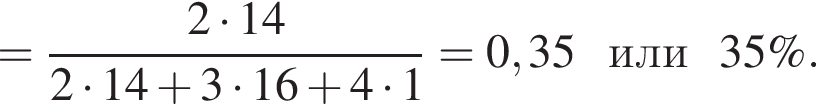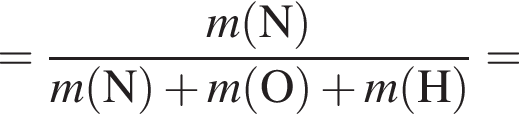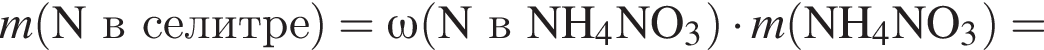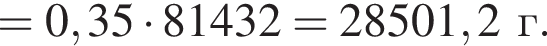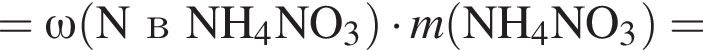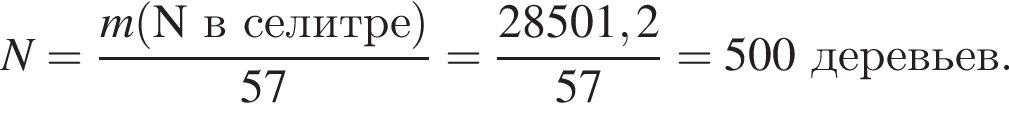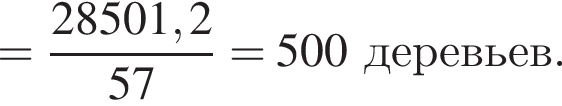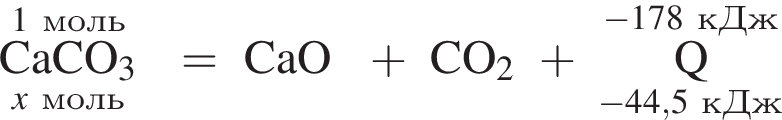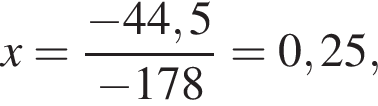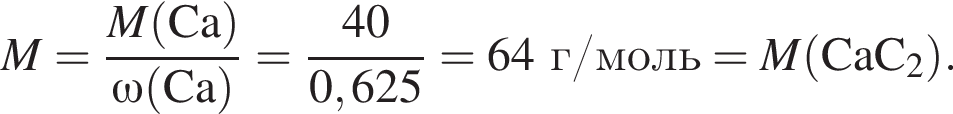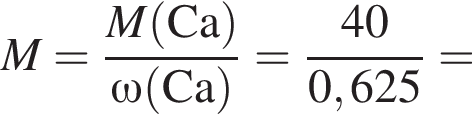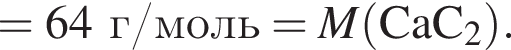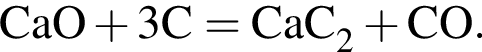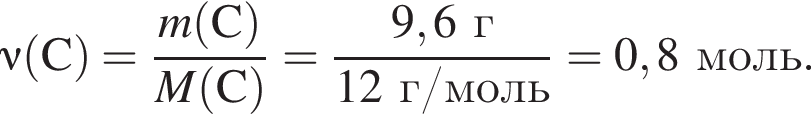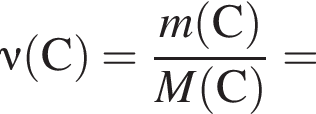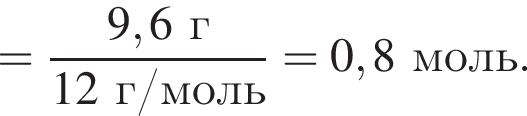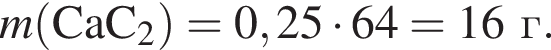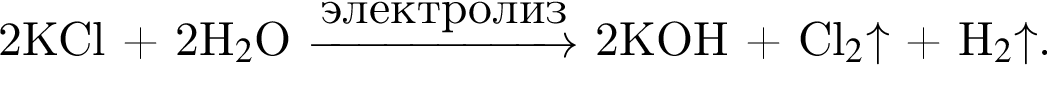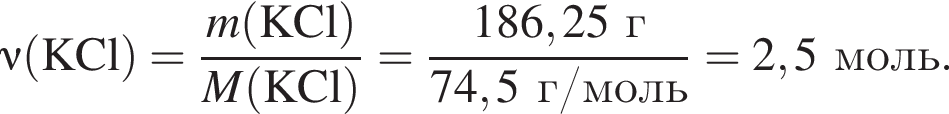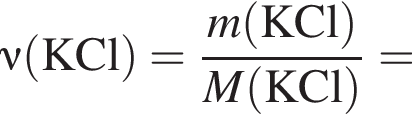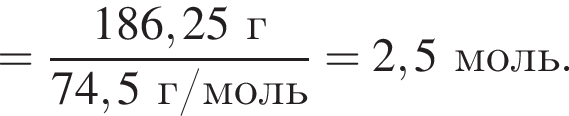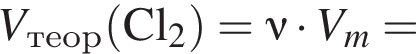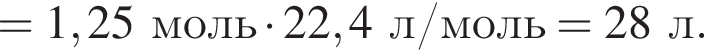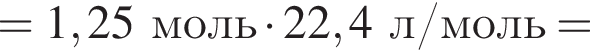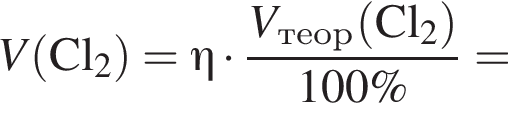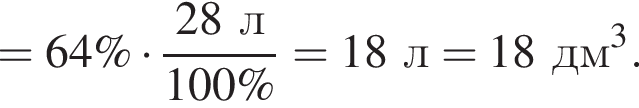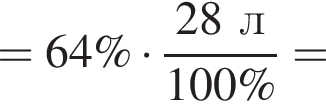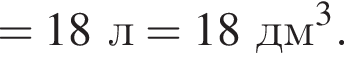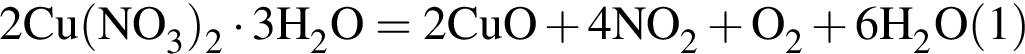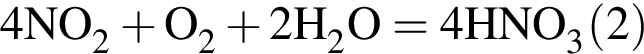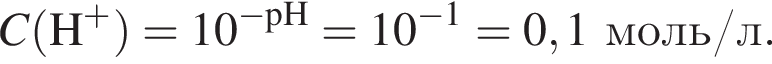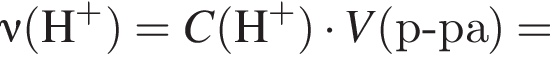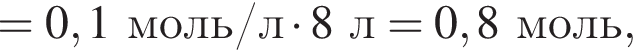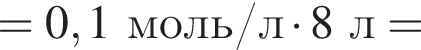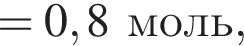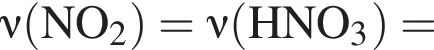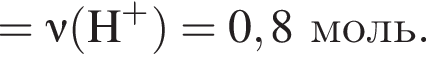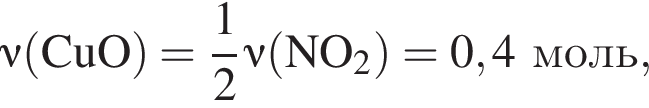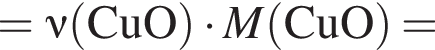В периодической системе в одной группе с кремнием находится химический элемент:
Укажите запись, соответствующую химическому элементу:
Атом ![]() и анион водорода
и анион водорода ![]() в основном состоянии подобны между собой:
в основном состоянии подобны между собой:
Согласно положению в периодической системе наибольшее значение электроотрицательности имеет химический элемент с порядковым номером:
Даны порции веществ одинакового объема (н. у.). Наибольшая масса у порции:
Для осуществления превращения 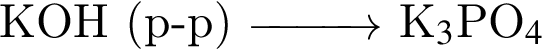 можно использовать вещество, формула которого:
можно использовать вещество, формула которого:
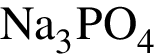 (р-р)
(р-р)Установите соответствие между формулой частицы и числом электронов, которые образуют химические связи в этой частице.
1 — ![]()
2 — ![]()
3 — ![]()
а — 2
б — 4
в — 6
г — 8
Простое вещество, в реакции с которым водород является окислителем:
Фенолфталеин приобретает малиновую окраску в растворе, который образуется при растворении в воде оксида:
Число веществ среди предложенных - 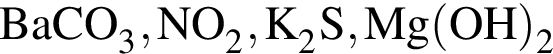 , с которыми реагирует разбавленный водный раствор
, с которыми реагирует разбавленный водный раствор ![]() :
:
Укажите верное утверждение:
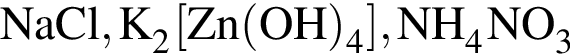 относятся к классу солей
относятся к классу солей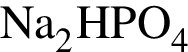 является слабым электролитом
является слабым электролитомУкажите верные утверждения относительно ряда элементов 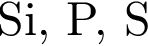 :
:
а) элементы ряда расположены по возрастанию металлических свойств
б) степень окисления атомов элементов в их высших оксидах возрастает от +4 до +6
в) один из элементов ряда относится к благородным газам
г) электронные конфигурации внешнего электронного слоя атомов элементов ряда в основном состоянии ...3s23p2, ...3s23p3 ...3s23p4 соответственно.
Формулы веществ (или ионов), в которых степень окисления азота равна соответственно +3, +5, -3, представлены в ряду:
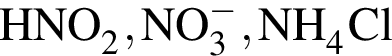

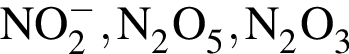

![]() в отличие от
в отличие от ![]() :
:
а — хорошо растворяется в воде
б — относится к сильным кислотам
в — НЕ образует осадок с раствором нитрата ртути(II)
г — НЕ окисляется хлором
Для кислорода и озона совпадает:
Укажите правильные утверждения относительно азота:
а) в молекуле имеется кратная связь
б) простое вещество состоит из полярных молекул
в) образуется при горении аммиака в кислороде
г) является газом (н. у.) без цвета и запаха
Общее число веществ из предложенных — 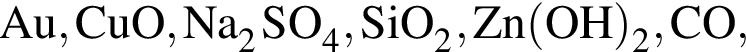 с которыми реагирует разбавленная соляная кислота, равно:
с которыми реагирует разбавленная соляная кислота, равно:
Выберите правильное утверждение:
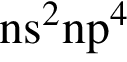
Аммиак является одним из продуктов реакции, схема которой:
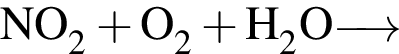
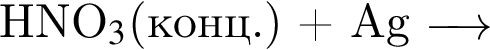
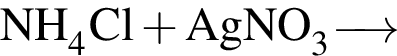
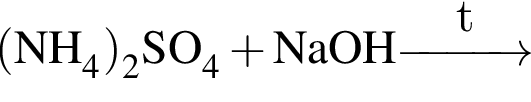
Разбавленная серная кислота реагирует с веществами (электролиты взяты в виде водных растворов):
а — 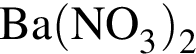
б — ![]()
в — ![]()
г — ![]()
С изменением степени окисления кремния протекают реакции:
а)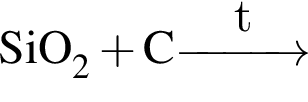 ;
;
б)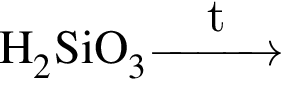 ;
;
в)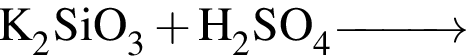 ;
;
г)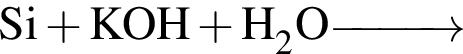 .
.
Смесь азота и кислорода объёмом (н. у.) 400 см3 пропустили над металлическим литием. В результате смесь полностью поглотилась с образованием нитрида и оксида лития. Масса твёрдого вещества при этом увеличилась на 0,545 г. Укажите плотность (г/дм3, н. у.) исходной смеси азота с кислородом:
При разложении карбоната кальция количеством 2 моль расходуется 314 кДж теплоты. Количество теплоты (кДж), затраченное на разложение известняка массой 1 кг, содержащего 8 % инертных примесей, равно:
Дана левая часть уравнения (коэффициенты расставлены):
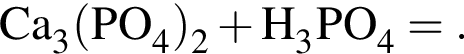
Укажите формулу продукта реакции:
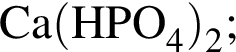
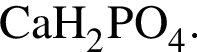
Лампочка прибора для определения электропроводности (см.рис) НЕ изменит яркость,если в разбавленный раствор
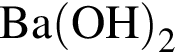 добавить:
добавить:
Укажите верное утверждение:
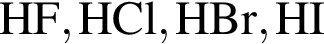 сила кислот уменьшается
сила кислот уменьшается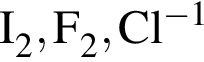 проявляют только восстановительные свойства
проявляют только восстановительные свойства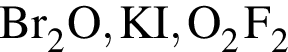 находятся в высшей степени окисления
находятся в высшей степени окисленияМодель молекулы этена изображена на рисунке:
Вещество, формула которого по систематической номенклатуре называется:
При действии воды на твердое вещество А образуется углеводород Б (легче воздуха). При присоединении к Б водорода получается углеводород В (также легче воздуха). В реакции В с водой в присутствии кислоты образуется соединение Г. При взаимодействии Г с муравьиной кислотой (в присутствии серной кислоты) получаются легкокипящая жидкость Д и неорганическое вещество Е. Найдите сумму молярных масс (г/моль) органических веществ Б, Г и Д.
Установите соответствие между формулой вещества и общей формулой гомологического ряда, к которому данное вещество принадлежит.
А)
Б)
В)
Г)
ГОМОЛОГИЧЕСКОГО РЯДА
1) 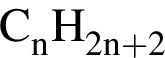
2) ![]()
3) 
4) 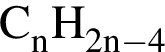
5) 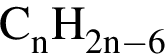
6) 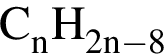
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б1B2Г6. Помните, что одни данные правого столбца могут использоваться несколько раз, а другие — не использоваться вообще.
При пропускании паров этанола массой 460 г в присутствии кислорода над медным катализатором в реакцию каталитического окисления вступило 45 % спирта, остальной спирт не прореагировал. Рассчитайте массу (г) кислорода, необходимого для полного сжигания полученной смеси органических веществ.
Для осуществления превращений по схеме
![]() →
→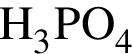 →
→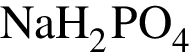 →
→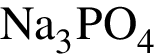 →
→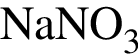
выберите реагенты из предложенных:
1 — 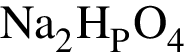
2 — ![]()
3 — 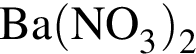
4 — 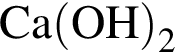
5 — 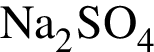
Ответ запишите цифрами в порядке следования превращений, например: 2443. Помните, что один реагент может использоваться несколько раз, а другой — не использоваться вообще.
Дан перечень неорганических веществ: аммиачная селитра, графит, гидроксид магния, гидросульфит калия, кремнезем, оксид фосфора(V), фтор, хлорид меди(II). Укажите число высших оксидов, нерастворимых оснований, солей и простых веществ соответственно.
Ответ запишите цифрами, соблюдая полученную последовательность, например: 1322.
Простое газообразное вещество А желто-зеленого цвета с резким запахом реагирует с металлом Б, в результате чего получается вещество В. Газ А имеет плотность (н. у.), равную 3,17г/дм3. Химический элемент, образующий Б, в соединениях имеет валентность II, а избыток его катионов обуславливает жесткость воды. При действии на В массой 25,02г избытка концентрированной серной кислоты с выходом 89% выделяется бесцветный, хорошо растворимый в воде газ Г объемом (н. у.) 10,5дм3. Определите сумму молярных масс (г/моль) веществ А и В.
Дана схема превращений
Вычислите сумму молярных масс (г /моль) вещества У и простого вещества Х, если известно, что вещество В не содержит медь.
При взаимодействии насыщенного ациклического одноатомного спирта с калием выделяется газ, объем которого в 8 раз меньше объема паров воды, образовавшейся при полном сгорании такой же порции спирта. Рассчитайте молярную массу (г/моль) спирта (объемы веществ измерены при одинаковых условиях).
Для анализа смеси, состоящей из ![]() и
и ![]() провели следующие операции. Навеску смеси массой 2,23 г растворили в воде. К полученному раствору прибавили 34,0 г раствора нитрата серебра(I) с массовой долей
провели следующие операции. Навеску смеси массой 2,23 г растворили в воде. К полученному раствору прибавили 34,0 г раствора нитрата серебра(I) с массовой долей 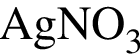 20%. Выпавший осадок отфильтровали, промыли, высушили и взвесили. Его масса оказалась равной 4,20 г. Вычислите массовую долю (%) ионов натрия в исходной смеси.
20%. Выпавший осадок отфильтровали, промыли, высушили и взвесили. Его масса оказалась равной 4,20 г. Вычислите массовую долю (%) ионов натрия в исходной смеси.
Найдите сумму молярных масс (г/моль) органических веществ ![]() и
и ![]() (вещество
(вещество ![]() не изменяет окраску лакмуса, вещество
не изменяет окраску лакмуса, вещество ![]() имеет немолекулярное строение) в схеме превращений
имеет немолекулярное строение) в схеме превращений
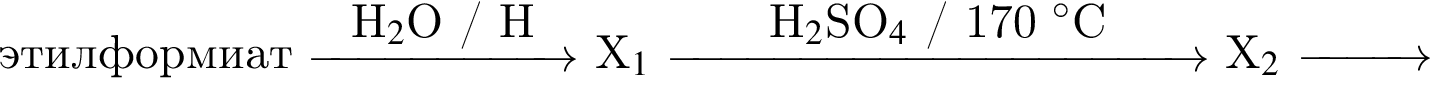
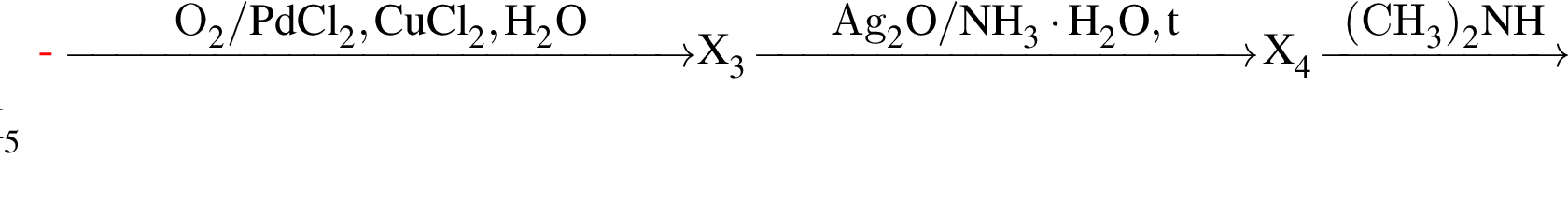
В герметичный сосуд постоянного объема поместили медный порошок массой 220 г и заполнили сосуд воздухом объёмом (н. у.) 140 дм3. В результате прокаливания порошка плотность газа в сосуде снизилась на 16 %. Опреде лите массу (г) твердого остатка после прокаливания.
Для анализов смеси хлоридов натрия и аммония провели следующие операции. Навеску смеси массой 5г растворили в воде. К полученному раствору прибавили 250г раствора гидроксида калия с массовой долей ![]() 2,8% и нагрели до полного удаления аммиака. В образовавшийся раствор добавили метиловый оранжевый, а затем акуратно прибавляли соляную кислоту, пока среда раствора не стала нейтральной. Объем израсходованной кислоты равен 190см3, концентрация HCl в кислоте 0,5моль/дм3. Вычислите массовую долю(%) хлорида аммония в исходной смеси.
2,8% и нагрели до полного удаления аммиака. В образовавшийся раствор добавили метиловый оранжевый, а затем акуратно прибавляли соляную кислоту, пока среда раствора не стала нейтральной. Объем израсходованной кислоты равен 190см3, концентрация HCl в кислоте 0,5моль/дм3. Вычислите массовую долю(%) хлорида аммония в исходной смеси.
Загрязненный аммиак объемом 24 м3 (н. у.) содержит 5% примесей (по объему). В результате поглощения всего аммиака избытком азотной кислоты была получена аммиачная селитра. Учитывая, что для подкормки одного плодового дерева необходимо 57 г химического элемента азота, рассчитайте, какое количество деревьев можно подкормить, используя полученную селитру.
Тепловой эффект реакции образования карбоната кальция из оксидов составляет 178 кДж/моль. Для полного разложения некоторого количества карбоната кальция потребовалось 44,5 кДж теплоты. Полученный оксид кальция спекали с углем массой 9,6 г в электропечи. Вычислите массу (г) образовавшегося при этом бинарного соединения, в котором массовая доля кальция равна 62,5%. (Примесями пренебречь.)
Электролиз водного раствора, содержащего хлорид калия массой 186,25 г, протекает по схеме
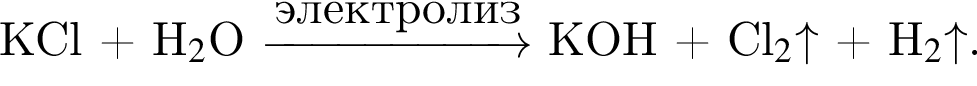
Рассчитайте объем (н. у., дм3) выделившегося в результате реакции хлора, если его выход составляет 64%.
Порцию кристаллогидрата соли 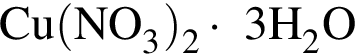 прокалили. Образовался черный порошок, а остальные продукты реакции были полностью поглощены водой. Образовавшийся раствор сильной кислоты объемом 8 дм3 имеет
прокалили. Образовался черный порошок, а остальные продукты реакции были полностью поглощены водой. Образовавшийся раствор сильной кислоты объемом 8 дм3 имеет ![]() Рассчитайте массу (г) черного порошка.
Рассчитайте массу (г) черного порошка.

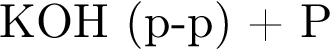 не пойдёт
не пойдёт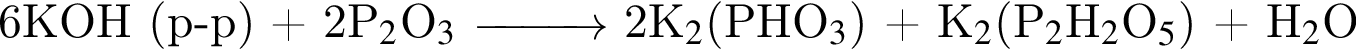
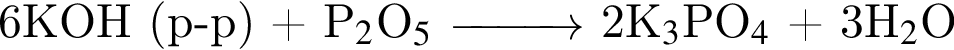
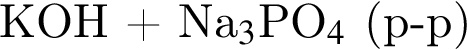 не пойдёт, поскольку в результате не образуется ни осадок, ни газ, ни слабый электролит.
не пойдёт, поскольку в результате не образуется ни осадок, ни газ, ни слабый электролит.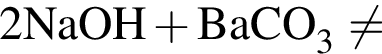
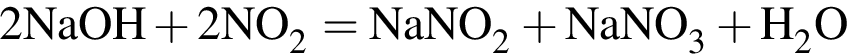
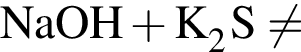
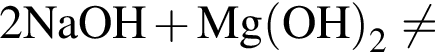
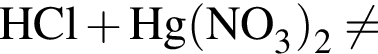
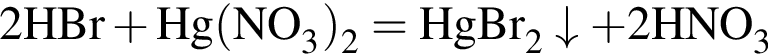
 .
.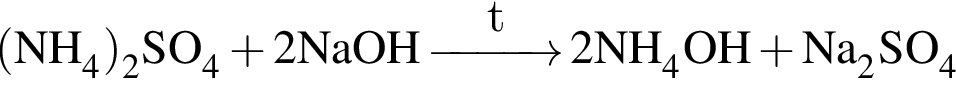
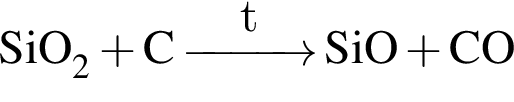
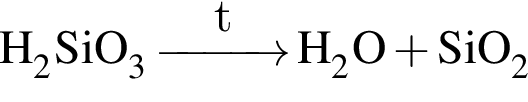

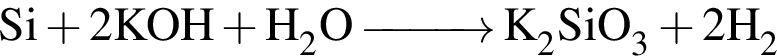
 ;
; .
.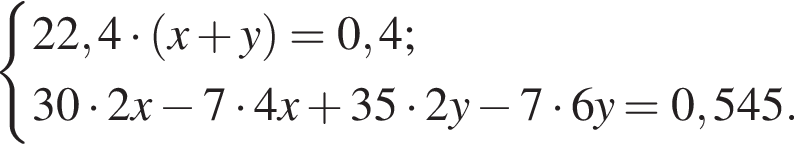
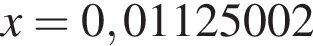 моль,
моль,  моль.
моль.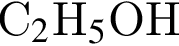 - этанолу (3),
- этанолу (3), 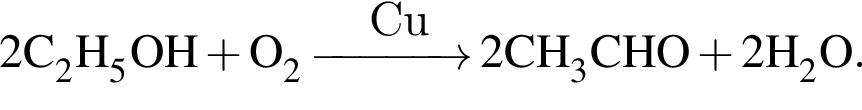
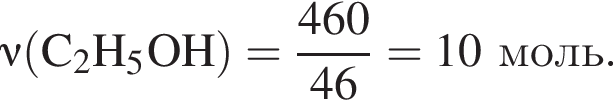
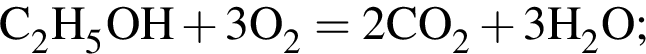
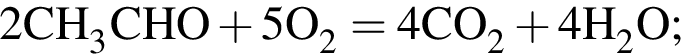
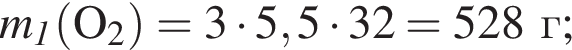
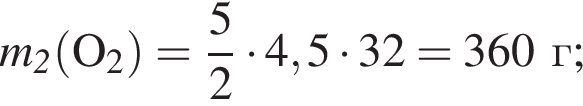
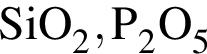 ;
;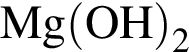 ;
;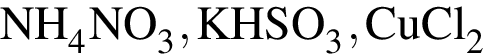 ;
;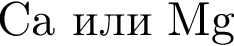 , т. к. они оба в соединениях имеют валентность II, а избыток их катионов обуславливает жесткость воды.
, т. к. они оба в соединениях имеют валентность II, а избыток их катионов обуславливает жесткость воды. 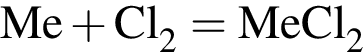 , где
, где 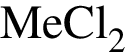 - вещество В.
- вещество В.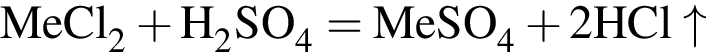 , где
, где 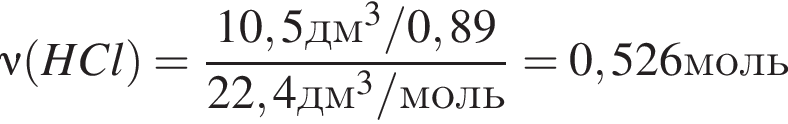
 Откуда
Откуда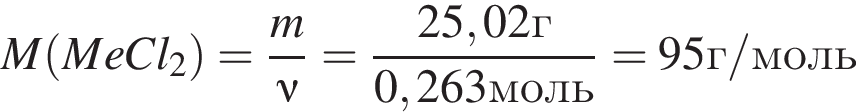

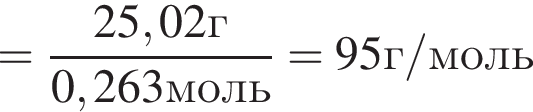

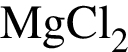 .
.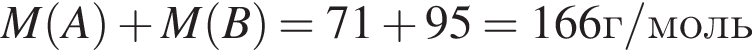
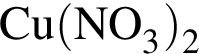
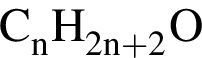 .
.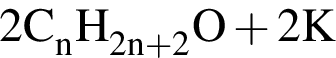 →
→ 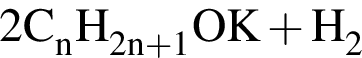
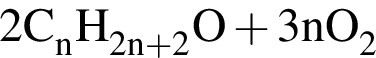 →
→ 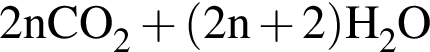
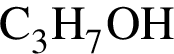 → M = 60 г/моль.
→ M = 60 г/моль.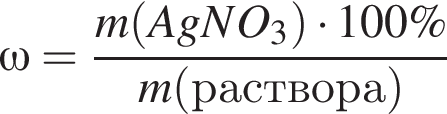
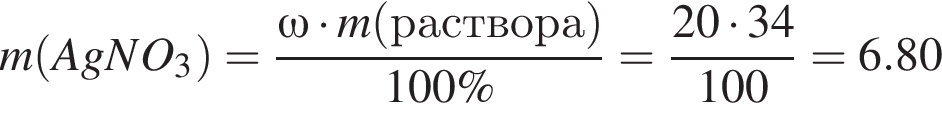
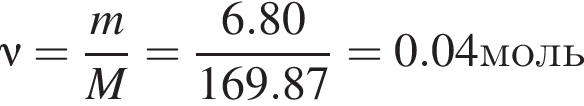
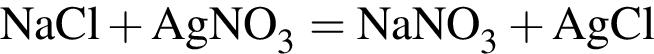 ↓
↓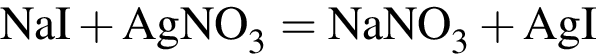 ↓
↓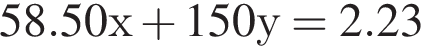
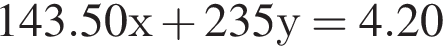
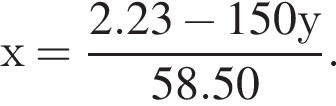 Подставим это выражение во второе уравнение системы.
Подставим это выражение во второе уравнение системы.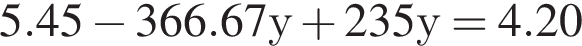 →
→ 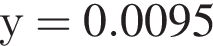 моль (
моль (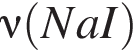 )
)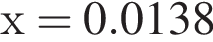 моль (
моль (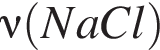 )
)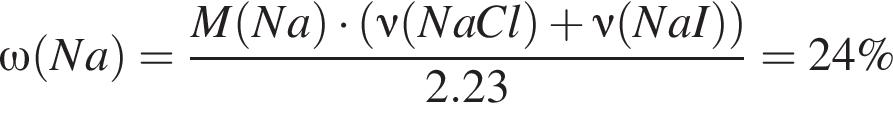
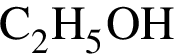
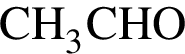 М=44 г/моль
М=44 г/моль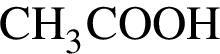
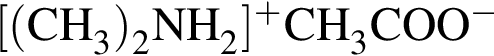 М=105 г/моль
М=105 г/моль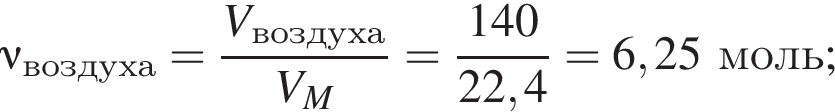
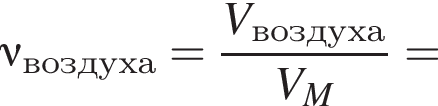
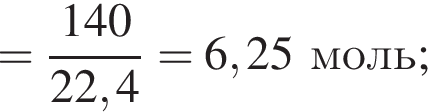




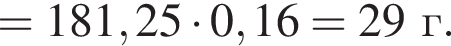

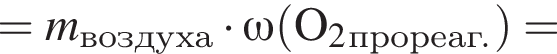
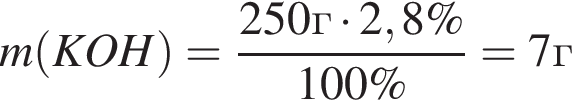
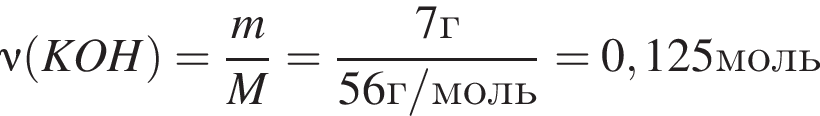
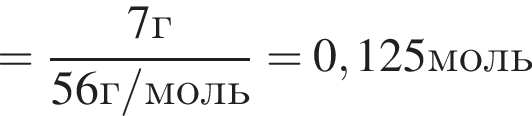
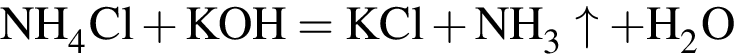 , оставшийся
, оставшийся 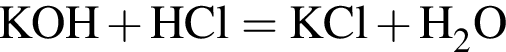
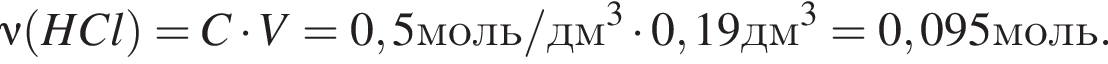

 прореагировало с
прореагировало с 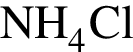 .
. Найдем массу хлорида аммония:
Найдем массу хлорида аммония: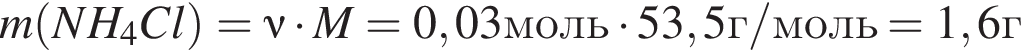

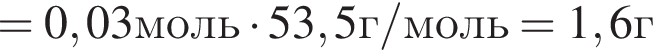
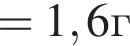
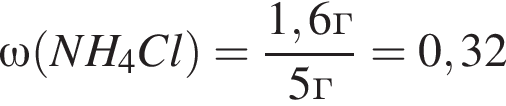 (32%)
(32%)